OXIDOS BÁSICOS
Un óxido básico o metálico; ya lo definimos es un compuesto binario formado por la unión de un metal con el oxígeno. en la Asignacuón I se escribieron las fórmulas de los más comunes usando la regla o definición siguiente:

Para formar óxidos básicos es fundamental conocer los metales; los más comunes se los enumeramos en una lista para que realizaran y aprendieran más rápido y facilmente la Asignación 1 del III Momento 2019~2020 de Química de Teecer Año de Educación Media General
El oxido básico es un compuesto binario porque su molécula está fornada por átomos de 2 elementos diferentes (el metal + el oxígeno).
Los óxidos básicos al reaccionar con el agua, forman compuestos llamados hidróxidos o bases.
Antes de ver ejemplos de óxidos básicos recordemos como se escriben y como se nombran.
En la Fòrmula: Siempre se escribe primero el símbolo del metal y después el símbolo del oxígeno, también recalcamos que el oxígeno siempre va a actuar con valencia 2.en todos los óxidos y número de oxidación -2.
Para nombrarlos se tienen formas diferentes: Tradicional, de Stock y Sistemática.
En la Nomenclatura Stock se aplica la siguiente regla:
Óxido de + Nombre del Metal + Valencia del metal en números romanos entre paréntesis. Si el metal solamente tiene una valencia no se escribe, se debe sobreentender. 1
Ejemplo 1.
Fórmula: CaO.
El número de oxidación del oxígeno siempre es -2 en todos los óxidos. Para conocer la valencia del calcio se procede así:
x - 2 = 0
Ca O
Se escribe la ecuación de primer grado:
x + ( -2) =0
Resolvemos los signos: x - 2 = 0
Se despeja x = 0 + 2 quedando x=2 que corresponde a la valencia del Calcio.
Por tanto, el nombre Stock del compuesto binario CaO es óxido de calcio y dado que el calcio únicamente tiene una valencia, no se escribe dentro del parentésis.
Ejemplo 2.
Fórmula: PbO2.
Se escribe la ecuación de primer grado:
x + 2 (-2) = 0
Resolvemos : x - 4 = 0 y despejanos x= 0 + 4 Resolvemos x = +4
Nombre Stock: óxido de plomo (IV)
Ejemplo 3.
Fórmula PbO
Ecuación de primer grado: x + (-2) = 0 Resolvemos: x - 2 = 0
Despejamos: x = 0 + 2.
Resolvemos: x = +2
Nombre Stock: óxido de plomo (II)
En la nomenclatura sistemática o estequiométrica se emplean prefijos numéricos griegos. Estos son:
N° Prefijo N° Prefijo
1 Mono 6 Hexa
2 Di 7 Hepta
3 Tri 8 Octa
4 Tetra 9 Nona
5 Penta 10 Deca
El prefijo mono rara vez se usa.
Para nombrar un óxido básico en Nomenclatura Sistemática se aplica la regla:
Préfijo + óxido + de + prefijo + nombre del metal
Ejemplo 4
Óxido de + Nombre del Metal + Valencia del metal en números romanos entre paréntesis. Si el metal solamente tiene una valencia no se escribe, se debe sobreentender. 1
Ejemplo 1.
Fórmula: CaO.
El número de oxidación del oxígeno siempre es -2 en todos los óxidos. Para conocer la valencia del calcio se procede así:
x - 2 = 0
Ca O
Se escribe la ecuación de primer grado:
x + ( -2) =0
Resolvemos los signos: x - 2 = 0
Se despeja x = 0 + 2 quedando x=2 que corresponde a la valencia del Calcio.
Por tanto, el nombre Stock del compuesto binario CaO es óxido de calcio y dado que el calcio únicamente tiene una valencia, no se escribe dentro del parentésis.
Ejemplo 2.
Fórmula: PbO2.
Se escribe la ecuación de primer grado:
x + 2 (-2) = 0
Resolvemos : x - 4 = 0 y despejanos x= 0 + 4 Resolvemos x = +4
Nombre Stock: óxido de plomo (IV)
Ejemplo 3.
Fórmula PbO
Ecuación de primer grado: x + (-2) = 0 Resolvemos: x - 2 = 0
Despejamos: x = 0 + 2.
Resolvemos: x = +2
Nombre Stock: óxido de plomo (II)
En la nomenclatura sistemática o estequiométrica se emplean prefijos numéricos griegos. Estos son:
N° Prefijo N° Prefijo
1 Mono 6 Hexa
2 Di 7 Hepta
3 Tri 8 Octa
4 Tetra 9 Nona
5 Penta 10 Deca
El prefijo mono rara vez se usa.
Para nombrar un óxido básico en Nomenclatura Sistemática se aplica la regla:
Préfijo + óxido + de + prefijo + nombre del metal
Ejemplo 4
Fórmula: Na2O
En la fórmula se ven 2 átomos de sodio y un átomo de oxígeno
Nombre Sistemático: óxido de disodio
Es incorrecto llamarle monóxido de disodio pues, repetimos, se sobreentiende el prefijo mono y menos correcto sería llamarle monoóxido pues la última vocal del prefijo numérico suele eliminarse, aunque no siempre la eliminan la mayoría de los autores y químicos.
Ejemplo 5.
Fórmula: CaO
Nombre Sistemático: óxido de calcio. Sólo hay un átomo de oxígeno y un átomo de calcio. Es incorrecto llamarle monóxido de monocalcio.
En la fórmula se ven 2 átomos de sodio y un átomo de oxígeno
Nombre Sistemático: óxido de disodio
Es incorrecto llamarle monóxido de disodio pues, repetimos, se sobreentiende el prefijo mono y menos correcto sería llamarle monoóxido pues la última vocal del prefijo numérico suele eliminarse, aunque no siempre la eliminan la mayoría de los autores y químicos.
Ejemplo 5.
Fórmula: CaO
Nombre Sistemático: óxido de calcio. Sólo hay un átomo de oxígeno y un átomo de calcio. Es incorrecto llamarle monóxido de monocalcio.
Ejemplo 6
Fórmula: Al2O3
Nombre sistemático:Trióxido de dialuminio
Ejemplo 7
Fórmula: Al2O3
Nombre sistemático:Trióxido de dialuminio
Ejemplo 7
Fórmula: K2O
Nombre Sistemático; Óxido de dipotasio
Nomenclatura tradicional o clásica
En este sistema de nomenclatura se indica la valencia del elemento metálico específico con una serie de prefijos y sufijos.
En general las reglas son:
1.- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento metálico el sufijo –ico.
2,- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.…
El sufijo oso se emplea cuando el metal trabaja con la valencia o estado de oxidación menor.
El sufijo -ico cuando el elemento usa la valencia o estado de oxidación mayor:.
3.-Cuando tiene tres valencias distintas se usan los prefijos y sufijos.
3.1.- hipo- … -oso para la menor valencia o el estado de oxidación menor:
3.2.. El sufijo -oso cuando el metal funciona con la valencia o estado de oxidación intermedio.
3.3.- El sufijo -ico se emplea para la mayor valencia o estado de oxidación mayor.
4.- Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos:
4.1.- hipo- … -oso para la valencia o estado de oxidación más pequeño
4.2.- El sufijo -oso para la valencia o estado de oxidación más pequeño)
4.3.- El sufijo -ico para la valencia o estado de oxidación grande.
4.4.- El prefijo per- y el sufijo -ico (para la valencia o estado de oxidación más grande.
4.5.- Cuando tiene cinco valencias o estado de oxidación diferentes se usan los prefijos y sufijos: hipo- … -oso (para la valencia o estado de oxidación más pequeño.
El sufijo -oso (para la valencia o estado de estado de oxidación medio-menor)
El sufijo -ico (para la valencia o estado de oxidación medio.
El prefijo per y el sufijo -ico (para la valencia o estado de oxidación medio-mayor
El prefijo hiper- y el sufijo -ico para la valencia o estado de oxidación mayor.
Nombre Sistemático; Óxido de dipotasio
Nomenclatura tradicional o clásica
En este sistema de nomenclatura se indica la valencia del elemento metálico específico con una serie de prefijos y sufijos.
En general las reglas son:
1.- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento metálico el sufijo –ico.
2,- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.…
El sufijo oso se emplea cuando el metal trabaja con la valencia o estado de oxidación menor.
El sufijo -ico cuando el elemento usa la valencia o estado de oxidación mayor:.
3.-Cuando tiene tres valencias distintas se usan los prefijos y sufijos.
3.1.- hipo- … -oso para la menor valencia o el estado de oxidación menor:
3.2.. El sufijo -oso cuando el metal funciona con la valencia o estado de oxidación intermedio.
3.3.- El sufijo -ico se emplea para la mayor valencia o estado de oxidación mayor.
4.- Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos:
4.1.- hipo- … -oso para la valencia o estado de oxidación más pequeño
4.2.- El sufijo -oso para la valencia o estado de oxidación más pequeño)
4.3.- El sufijo -ico para la valencia o estado de oxidación grande.
4.4.- El prefijo per- y el sufijo -ico (para la valencia o estado de oxidación más grande.
4.5.- Cuando tiene cinco valencias o estado de oxidación diferentes se usan los prefijos y sufijos: hipo- … -oso (para la valencia o estado de oxidación más pequeño.
El sufijo -oso (para la valencia o estado de estado de oxidación medio-menor)
El sufijo -ico (para la valencia o estado de oxidación medio.
El prefijo per y el sufijo -ico (para la valencia o estado de oxidación medio-mayor
El prefijo hiper- y el sufijo -ico para la valencia o estado de oxidación mayor.
Ejemplo 8
Fórmula: Na2O
El Sodio tiene el número de oxidación +1 o valencia 1
En este caso se aplica la "regla 1.- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento metálico el sufijo –ico."
Por tanto, el nombre tradicional es óxido de sodio u óxido sódico.
Ejemplo 9.
Fórmula: CaO
El calcio únicante tiene una valencia o número de oxidación y se nombra en la nomenclatura tradicional aplicando la misma regla 1 y se llama óxido de calcio u óxido cálcico.
El Sodio tiene el número de oxidación +1 o valencia 1
En este caso se aplica la "regla 1.- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento metálico el sufijo –ico."
Por tanto, el nombre tradicional es óxido de sodio u óxido sódico.
Ejemplo 9.
Fórmula: CaO
El calcio únicante tiene una valencia o número de oxidación y se nombra en la nomenclatura tradicional aplicando la misma regla 1 y se llama óxido de calcio u óxido cálcico.
Ejemplo 10
Fórmula: Al2O3
Al igual que el sodio y el calcio, el átomo de aluminio tiene una sola valencia o número de oxidación. Aplica la misma regla 1.
Nombre Tradicional :óxido de aluminio u óxido alumínico.
Ejemplo 11
Fórmula: Cu2O
El cobre tiene dos valencia o dos número de oxidación: 1 y 2
Óxido Cuproso
Fórmula: Al2O3
Al igual que el sodio y el calcio, el átomo de aluminio tiene una sola valencia o número de oxidación. Aplica la misma regla 1.
Nombre Tradicional :óxido de aluminio u óxido alumínico.
Ejemplo 11
Fórmula: Cu2O
El cobre tiene dos valencia o dos número de oxidación: 1 y 2
Óxido Cuproso
4. CaO Óxido de Calcio
5. CuO Óxido Cúprico
6. FeO Óxido Ferroso
7. PbO Óxido de Plomo
8. óxido de litio= 4Li +O2---> 2Li20.
9. óxido de Aluminio: 2Al2O3.
10. O. de Sodio= 2NaO.
11. Ó. de Plata= 2AgO2.
12. Ó. de Calcio= CaO.
13. O. de Bario= BaO.
14. O. de Magnesio= MgO
15. Ó. de Potasio= 2KO
16. O. Niquélico= Ni2O3.
17. O. Ferroso= FeO
18. O. Estánnico= SnO2
19. O. Plumboso= PbO
20. O. Plúmbico= PbO2
21. O. Mercúrico= HgO
22. O. Áurico= Au2O3. ..... :3
Ahora otra tabla con 12 ejemplos (algunas está repetido en la de arriba):
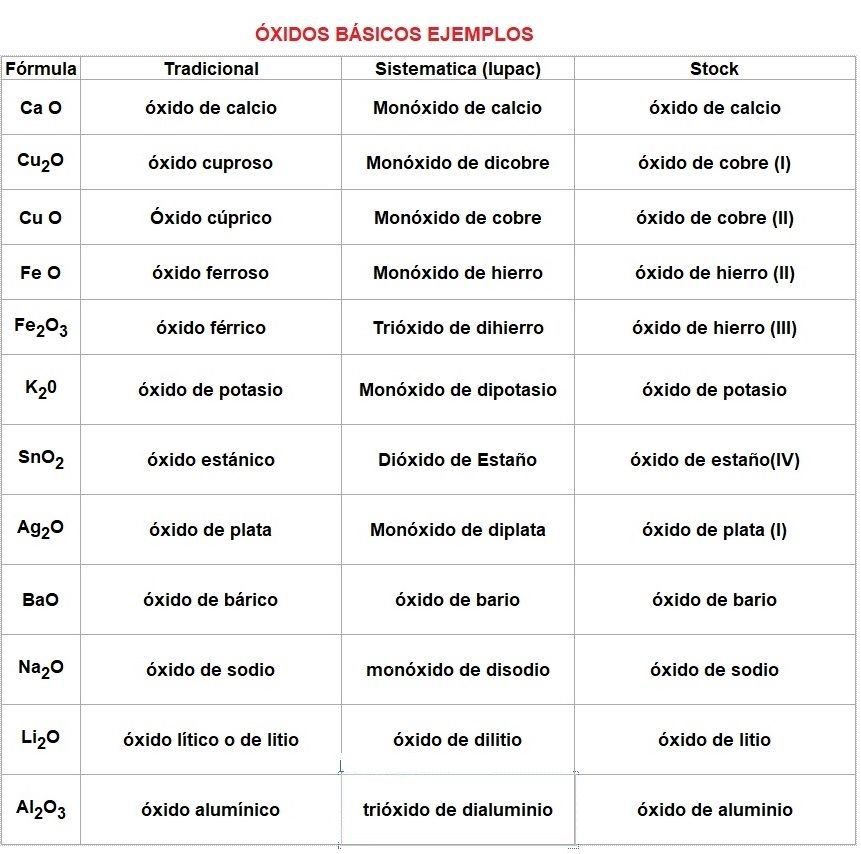
Otra Lista con más ejemplos:
Ag2O Oxido básico De plata
Al2O3 Oxido básico De aluminio
Au2O Oxido básico Auroso
Au2O3 Oxido básico Aúrico
BaO Oxido básico De bario
BeO Oxido básico De berilio
Bi2O3 Oxido básico Bismutoso
Bi2O5 Oxido básico Bismútico
CaO Oxido básico De calcio
Cr2O3 Oxido básico Crómico
CrO Oxido básico Cromoso
Cu2O Oxido básico Cuproso
CuO Oxido básico Cúprico
Fe2O3 Oxido básico Férrico
FeO Oxido básico Ferroso
Hg2O Oxido básico Mercurioso
HgO Oxido básico Mercúrico
K2O Oxido básico De potasio
Li2O Oxido básico De litio
MaO Oxido básico De magnesio
Mn2O3 Oxido básico Mangánico
MnO Oxido básico Manganoso
Na2O Oxido básico De sodio
Ni2O3 Oxido básico Niquélico
NiO Oxido básico Niqueloso
PbO Oxido básico Plumboso
PbO2 Oxido básico Plúmbico
SnO Oxido básico Stanoso
SnO2 Oxido básico Stánico
ZnO Oxido básico De cinc

No hay comentarios.:
Publicar un comentario