Este Modelo fue propuesto en 1916 por el físico alemán Arnold Sommerfeld (1868-1951), básicamente es una generalización relativista del modelo atómico de Bohr de 1913; la propuesta buscaba superar las debilidades del modelo atómico de Bohr.
El modelo atómico de Bohr explicaba bien las propiedades del átomo de hidrógeno, sin embargo, en los espectros realizados para átomos de otros elementos se observaban electrones de un mismo nivel energético con distinta energía, mostrando que había un error en el modelo. Sommerfeld postuló que dentro de un mismo nivel energético existían subniveles, esto es, energías ligeramente diferentes. Además, desde el punto de vista teórico, había encontrado que en ciertos átomos las velocidades de los electrones alcanzaban una fracción apreciable de la velocidad de la luz. Sommerfeld estudió el problema para electrones relativistas.
Características del modelo atómico de Sommerfeld
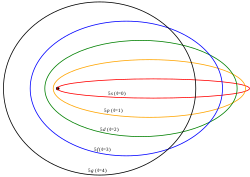
Órbitas elípticas en el modelo de Sommerfeld.
En 1916, Sommerfeld perfeccionó el modelo atómico de Bohr intentando resolver los dos principales defectos de este. Para ello introdujo dos modificaciones básicas: 1.- Órbitas cuasi elípticas para los electrones y 2.- velocidades relativistas. En el modelo de Bohr los electrones solo giraban en órbitas circulares. La excentricidad de la órbita dio lugar al número cuántico azimutal, que determina la forma de los orbitales, se representa con la letra ℓ
y toma valores que van desde 0 hasta n-1.
Las órbitas son:
ℓ = 0 se denominarían posteriormente orbitales s o sharp
ℓ = 1 se denominarían p o principal.
ℓ= 2 se denominarían d o diffuse.
ℓ = 3 se denominarían f o fundamental.
Para n=1 los valores de ℓ son ℓ= 0 hasta (n-1); substuyendo n por el valor indicado tenemos que ℓ= 0 hasta (1-1), es decir, ℓ= 0 hasta 0
∴ ℓ=0 y los electrones se encuentran en el orbital s.
Para n=1 los valores de ℓ son ℓ= 0 hasta (n-1); substuyendo n por el valor indicado tenemos que ℓ= 0 hasta (1-1), es decir, ℓ= 0 hasta 0
∴ ℓ=0 y los electrones se encuentran en el orbital s.
Para n=2 ℓ=0 hasta (2-1),
∴ ℓ=0,1 y habrían dos orbitales, el orbital s para ℓ=0 y el orbital p para ℓ=1
Si n=3 ℓ=0,1,2 y se tendrían tres orbitales: s, p y d.
Para n=4 se tienen los valores de ℓ=0,1,2,3 y corresponden a los orbitales s,p,d,f y así sucesivamente.
Para hacer coincidir las frecuencias calculadas con las experimentales, Sommerfeld postuló que el núcleo del átomo no permanece inmóvil, sino que tanto el núcleo como el electrón se mueven alrededor del centro de masas del sistema, que estará situado muy próximo al núcleo al tener este una masa varios miles de veces superior a la masa del electrón.
Para explicar el desdoblamiento de las líneas espectrales, observado al emplear espectroscopios de mejor calidad, Sommerfeld supuso que las órbitas del electrón pueden ser circulares y elípticas. Introdujo el número cuántico secundario o azimutal, llamado ℓ, que tiene los valores 0, 1, 2,…(n-1), e indica el momento angular del electrón en la órbita en unidades de Constante de Planck reducida o h/2π,(veáse https://es.wikipedia.org/wiki/Constante_de_Planck), determinando los subniveles de energía en cada nivel cuántico y la excentricidad de la órbita.
En síntesis:
En 1916, Arnold Sommerfeld, apoyándose en la teoría de la relatividad de Albert Einstein, hizo las siguientes modificaciones al modelo de Bohr:
1.- Los electrones se mueven alrededor del núcleo, en órbitas circulares o elípticas.
2.- A partir del segundo nivel energético ex. isten dos o más subniveles en el mismo nivel.
3.- El electrón es una corriente eléctrica minúscula.
En 1916, Arnold Sommerfeld, apoyándose en la teoría de la relatividad de Albert Einstein, hizo las siguientes modificaciones al modelo de Bohr:
1.- Los electrones se mueven alrededor del núcleo, en órbitas circulares o elípticas.
2.- A partir del segundo nivel energético ex. isten dos o más subniveles en el mismo nivel.
3.- El electrón es una corriente eléctrica minúscula.
En consecuencia, el modelo atómico de Sommerfeld es una generalización del modelo atómico de Bohr desde el punto de vista relativista, aunque no pudo demostrar las formas de emisión de las órbitas elípticas, solo descartó su forma circular.
╔Ģ╗
☺ ═╝
╔Ģ╗
☺ ═╝


No hay comentarios.:
Publicar un comentario