ENLACE QUÍMICO
los átomos de un mismo elemento pueden unirse entre sí para formar las moléculas de las sustancias simples, tales como hidrógeno, H2, Nitrógeno, N2, Oxígeno, O2, y Cloro, Cl2, entre otras. O pueden combinarse con átomos diferentes para originar compuestos de carácter iónico o molecular. En todos los casos se mantienen unidos mediante una fuerza de atracción llamada Enlace Químico.
El enlace químico puede ser:
1.- Iónico o electrovalente y
2.- Covalente, este, a su vez, puede ser
2.1.-Normal, Simple o Sencillo
2.2.- Doble
2.3.- Triple
2.4.- Coordinado o Dativo
1.-ENLACE IÓNICO O ELECTROVALENTE
Entre los iones: Na+ y F- surge una fuerza de atracción electrostática, por ser de signos opuestos, que se conoce como Enlace Iónico.
2.- ENLACE COVALENTE
En este caso no hay trasferencia de electrones, sino que los electrones son compartidos por cada uno de los átomos que intervienen en la molécula.
Ejemplo 1: molécula de hidrógeno, H2
Configuración electrónica: 1s1 Diagrama de Orbital: ↑
—
1s
Para que cada átomo, de los dos que posee la molécula de hidrógeno, alcance la configuración electrónica del gas inerte Helio, He, necesita de un electrón y como ambos átomos tienen el mismo potencial de ionización y la misma afinidad electrónica, ninguno de los dos átomos transfiere al otro su electrón, sino que ambos comparten los electrones que por separado tiene cada uno y de este modo cada átomo adquiere la estabilidad de la configuración de gas inerte. Este proceso se representa mediante la notación punto-electrón, conocida también como Notación de Lewis, siguiente:
H• + H•→H : H o H — H
Ejemplo 2: molécula de cloro, Cl2
La configuración electrónica del átomo de cloro, Cl, muestra que tiene siete electrones de valencia (7e-) distribuidos así:
El enlace químico puede ser:
1.- Iónico o electrovalente y
2.- Covalente, este, a su vez, puede ser
2.1.-Normal, Simple o Sencillo
2.2.- Doble
2.3.- Triple
2.4.- Coordinado o Dativo
1.-ENLACE IÓNICO O ELECTROVALENTE
Es el tipo de enlace que se establece por transferencia completa de uno (1) o más electrones(e- desde un átomo a otro, dando origen a dos iones de cargas opuestas que tienen una configuración estable de gas inerte. Por ejemplo, en la reacción entre el flúor y el sodio para formar fluoruro de sodio se genera este tipo de enlace. En este caso el átomo de sodio, con más baja energía de ionización, cede su único electrón de valencia convirtiéndose en catíón sodio, Na+, quedando con ocho electrones en el último nivel de energía, adquiriendo la misma configuración electrónica del gas inerte Neón. Este proceso se ilustra del siguiente modo:
1.-Formación del catión sodio:
11Na (1s22s22p63s1) → 11Na+ (1s22s22p6) + e-
2-8-1 2-8
2.-Formación del anión fluoruro:
9F: (1s22s22p5) + e- → 9F-: (1s22s22p6)
1.-Formación del catión sodio:
11Na (1s22s22p63s1) → 11Na+ (1s22s22p6) + e-
2-8-1 2-8
2.-Formación del anión fluoruro:
Entre los iones: Na+ y F- surge una fuerza de atracción electrostática, por ser de signos opuestos, que se conoce como Enlace Iónico.
2.- ENLACE COVALENTE
En este caso no hay trasferencia de electrones, sino que los electrones son compartidos por cada uno de los átomos que intervienen en la molécula.
Ejemplo 1: molécula de hidrógeno, H2
Configuración electrónica: 1s1 Diagrama de Orbital: ↑
—
1s
Para que cada átomo, de los dos que posee la molécula de hidrógeno, alcance la configuración electrónica del gas inerte Helio, He, necesita de un electrón y como ambos átomos tienen el mismo potencial de ionización y la misma afinidad electrónica, ninguno de los dos átomos transfiere al otro su electrón, sino que ambos comparten los electrones que por separado tiene cada uno y de este modo cada átomo adquiere la estabilidad de la configuración de gas inerte. Este proceso se representa mediante la notación punto-electrón, conocida también como Notación de Lewis, siguiente:
H• + H•→H : H o H — H
Ejemplo 2: molécula de cloro, Cl2
La configuración electrónica del átomo de cloro, Cl, muestra que tiene siete electrones de valencia (7e-) distribuidos así:
3s23p5 y con Diagrama de orbital: ↑↓ ↑↓ ↑↓ ↑
— — — —
3s 3px 3py 3pz
└═══∨═══┘
— — — —
3s 3px 3py 3pz
└═══∨═══┘
3p
Ejemplo 3. Molécula de cloruro de hidrógeno, HCl
Al aproximarse los dos átomos de cloro cada uno contribuye al enlace con el único electrón desapareado que posee (3pz), en estableciéndose entre ambos átomos un enlace covalente normal en el que cada átomo de cloro queda con ocho (8) electrones de valencia en la molécula de cloro, adquiriendo la configuración estable del gas inerte Argón, Ar.
El proceso es:
•• •• •• ••
: Cl . + : Cl . → : Cl : Cl : o Cl—Cl
: Cl . + : Cl . → : Cl : Cl : o Cl—Cl
•• •• •• ••
2-8-7 2-8-7
2-8-7 2-8-7
Los átomos constitutivos de la especie química Cloruro de Hidrógeno tienen la configuración electrónica en sus electrones de valencia siguientes:
H: Configuración electrónica: 1s1 Diagrama de Orbital: ↑
—
1s
— — — —
3s 3px 3py 3pz
└═══∨═══┘
3s 3px 3py 3pz
└═══∨═══┘
3p
‥
El proceso de formación del enlace covalente normal simple es: •• •• ••
H• + : Cl . + : Cl . → H : Cl : o H—Cl
‥
El proceso de formación del enlace covalente normal simple es: •• •• ••
H• + : Cl . + : Cl . → H : Cl : o H—Cl
•• •• ••
∴ El átomo de hidrógeno adquiere la configuración del gas inerte Helio y el átomo de cloro la configuración del gas inerte Argón.
Cuando se requiere conocer el número de electrones compartidos, llamados electrones enlazantes, y los electrones no compartidos, asociados sólo a un átomo, y la manera en que están distribuidos en las estructuras de Lewis ayuda mucho la ecuación matemática siguiente:
∴ El átomo de hidrógeno adquiere la configuración del gas inerte Helio y el átomo de cloro la configuración del gas inerte Argón.
Cuando se requiere conocer el número de electrones compartidos, llamados electrones enlazantes, y los electrones no compartidos, asociados sólo a un átomo, y la manera en que están distribuidos en las estructuras de Lewis ayuda mucho la ecuación matemática siguiente:
C = Nt - D
donde:
C: número de electrones compartidos en la molécula o ión poliatómico.
D: número de electrones de valencia de todos los átomos que forman parte de la molécula o del ión poliatómico.
Nt: número total de electrones de valencia que necesitan todos los átomos de la molécula o ión para alcanzar la configuración electrónica estable de gas inerte.
Para conocer el número de enlaces compartidos se aplica la fórmula E= C/2
Ejemplo 4.- Escriba las estructuras de Lewis para la molécula de bromo, Br2
Cada átomo de bromo necesita de 8e- por lo que Nt= 2(8 e-) = 16 e-
además,tenemos que cáda átomo de bromo tiene 7 e- de valencia disponibles, por esto
D= 2(7e-) = 14 e- y C = 16e- - 14 e-= 2e-
Ejemplo 4.- Escriba las estructuras de Lewis para la molécula de bromo, Br2
Cada átomo de bromo necesita de 8e- por lo que Nt= 2(8 e-) = 16 e-
además,tenemos que cáda átomo de bromo tiene 7 e- de valencia disponibles, por esto
D= 2(7e-) = 14 e- y C = 16e- - 14 e-= 2e-
El número de enlaces sería: C/2, esto es, 2/2= 1
Por tanto, la estructura de Lewis de la molécula de bromo sería
.. ..
:Br― Br:
.. ..
Ejemplo 5.- Molécula de CO2
Nt= 8e- + 2(8e-)= 24e-
Por tanto, la estructura de Lewis de la molécula de bromo sería
.. ..
:Br― Br:
.. ..
Ejemplo 5.- Molécula de CO2
Nt= 8e- + 2(8e-)= 24e-
C = 24e- - 16e- = 8e-
E= 8÷2 = 4 enlaces
Debido a que CO2 es una molécula triatómica hay que decidir cuál de los tres átomos será el central, para ello se aplica la regla según la cual el átomo central será aquel que necesite de mayor número de electrones para ajustarse a la regla del octeto, en este caso el átomo central es el átomo de carbono pues tiene 4e-en su estado fundamental y requiere de 4e- en cambio el oxígeno con 6e- de valencia sólo necesita de 2e- para cumplir con la regla del octeto,de aquí que la estructura de Lewis sea: .. ..
: O=C=O :
Ejemplo 6.- Caso de los aniones.
Un buen ejemplo para ilustrar la estructura de Lewis para estos casos lo constituye el anión fosfato, PO4-3
D = 5e- + 4(6e-) + 3e- ⇒ D=32e-
C = 40e- - 32e- ⇒ C= 8e-
E= 8÷2 = 4 enlaces
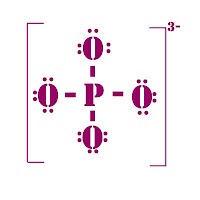 |
| Estructura de Lewis del anión fosfato |
Ejemplo 7.- Otro buen ejemplo lo constituye el grupo funcional alilo, se trata de un alqueno, con doble enlace en la cadena carbonada, de fórmula condensada C3H5+ para el catión alilo y C3H5- para el anión alilo. Determinemos la estructura de Lewis para ambos iones
Catión Alilo. C3H5+:
D = Alilo: C3H5-:
D = 3( 4e- ) + 5(1e-) + 1e- ⇒ D=18e-
C = 34e- - 18e- ⇒ C= 16e-
E= 16÷2 = 8 enlaces
a) H2O b) O2 c) N2 d) [H3O]+ e) H3PO4 f) H2CO3 g) HClO h) PH3 i) F2 j)CCl4 k) SO2 l) HBr m)HNO3 n) CH4 o) HClO2 p) H2SO4
e indique los enlaces químicos existentes en cada especie, señalando el tipo de enlace y los representando mediante guiones interatómicos cada enlace compartidos
2.- Para la reacción entre el cloruro de hdrógeno y el amoníaco:
a) Escriba la ecuación usando la notación punto-electrón o de Lewis
b) Indique los tipos de enlaces presentes en el compuesto formado, cloruro de amonio, NH4Cl
Actividad complementaria. Traduzca:
Allium sativum
facts and
myths regarding human health.
Garlic (Allium sativum L.
fam. Alliaceae) is one of the most researched and best-selling herbal products
on the market. For centuries it was used as a traditional remedy for most
health-related disorders. Also, it is widely used as a food ingredient--spice
and aphrodisiac. Garlic's properties result from a combination of variety
biologically active substances which all together are responsible for its
curative effect. The compounds contained in garlic synergistically influence
each other so that they can have different effects. The active ingredients of
garlic include enzymes (e.g. alliinase), sulfur-containing compounds such as
alliin and compounds produced enzymatically from alliin (e.g. allicin). There
is a lot of variation among garlic products sold for medicinal purposes. The
concentration of Allicin (main active ingredient) and the source of garlic's
distinctive odor depend on processing method. Allicin is unstable, and changes
into a different chemicals rather quickly. It's documented that products obtained
even without allicin such as aged garlic extract (AGE), have a clear and
significant biological effect in immune system improvement, treatment of
cardiovascular diseases, cancer, liver and other areas. Some products have a
coating (enteric coating) to protect them against attack by stomach acids.
Clinically, garlic has been evaluated for a number of purposes, including
treatment of hypertension, hypercholesterolemia, diabetes, rheumatoid
arthritis, cold or the prevention of atherosclerosis and the development of
tumors. Many available publications indicates possible antibacterial,
anti-hypertensive and anti-thrombotic properties of garlic. Due to the chemical
complexity of garlic and the use of different processing methods we obtain
formulations with varying degrees of efficacy and safety.
Comentarios por:
plus.google.com/+ProfGonzaloVSolanoL
Comentarios por:
plus.google.com/+ProfGonzaloVSolanoL


No hay comentarios.:
Publicar un comentario