RESONANCIA O MESOMERÍA
A mediados del siglo XIX, se sabía que el benceno era insaturado, con una formula C6H6, la cual requería cuatro dobles enlaces, anillos o una combinación de ambas cosas. Además se sabía que no experimenta reacciones características de alquenos, como por ejemplo, cuando se le hace reaccionar lentamente con bromo en presencia de hierro, se formara un producto de sustitución C6H5Br, en vez del grupo C6 6H4Br2, que es el de adición, y no se producían otros isómeros distintos.
RESONANCIA O MESOMERÍA
A mediados del siglo XIX, se sabía que el benceno era insaturado, con una formula C6H6, la cual requería cuatro dobles enlaces, anillos o una combinación de ambas cosas. Además se sabía que no experimenta reacciones características de alquenos, como por ejemplo, cuando se le hace reaccionar lentamente con bromo en presencia de hierro, se formara un producto de sustitución C6H5Br, en vez del grupo C6 6H4Br2, que es el de adición, y no se producían otros isómeros distintos.
Basándose en estos resultados, August Kekulé propuso en 1865 que el benceno consiste en un anillo de carbonos y que puede formularse como un 1,3,5-ciclohexatrieno, lo que explicaba la formación de un solo sustituyente del monobromado.
El problema partía en el dibromado, ya que existían cuatro isómeros, dos 1,2-dibromociclohexatrieno, uno 1,3-dibromociclohexatrieno y uno 1,4-dibromociclohexatrieno. Esto lo explicó Kekulé diciendo que los dobles enlaces se mueven con gran rapidez, con lo cual los bromos no pueden separarse.
El movimiento de los enlaces ocurre velozmente.
Teoría de resonancia
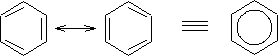
Como Kekulé dijo el benceno presenta dos posibles estructuras equivalentes en la cual cada enlace carbono - carbono es en promedio 1,5 enlaces; el valor medio entre el doble y el sencillo.
A continuación se verá los cuatro postulados de la teoría de resonancia del benceno y de los hidrocarburos aromáticos:
Las estructuras resonantes son imaginarias, no reales. La estructura del benceno es un híbrido que no cambia, único, en el que se combinan ambas formas de resonancia.
Las estructuras resonantes difieren solo en las exposiciones de sus electrones. Ni la posición, ni la hibridación de los átomos cambia de una estructura de resonancia a otra. En el benceno los seis núcleos de carbono forman un hexágono regular, mientras que los electrones Pi son compartidos por igual entre los núcleos vecinos, cada enlace carbono - carbono tiene un promedio de 1,5 electrones, y todos los enlaces son equivalentes.
Las distintas formas de resonancia no tienen que ser equivalentes. Sin embargo mientras más equivalentes sean las formas, tanto más estable será la molécula. Así el benceno con dos formas de resonancia equivalentes, es muy estable.
Tanto más estructuras de resonancia haya, tanto más estable será la molécula.
Se puede concluir que la estructura del benceno es única y no oscila entre dos estructuras de Kekulé; pero por convención se dice que el benceno toma una de las estructuras resonantes, para mayor facilidad de trabajo con su estructura en forma escrita. Cabe destacar que cualquiera de las estructuras de Kekulé que se tomen serán en consecuencia equivalentes.
Resonancia del catión, anión y radical alilo
El sistema alilo forma carbocationes, carbaniones y radicales estables debido a la estabilización de la carga por resonancia. Las cargas positiva, negativa y el radical se deslocalizan sobre dos átomos de carbono generando híbridos de resonancia energéticamente equivalentes llamados alilo. El carbono que soporta la carga se conoce como posición alílica.
Otros ejemplos de resonancia en sistemas alílicos es el catión ciclohexenilo:
La representación de una molécula o de un ión por dos o más estructuras de Lewis que difieren sólo en la posición de sus electrones”Implica colocar en forma alternada los electrones no enlazantes o electrones pi (π) a lo largo del mismo esqueleto atómico, sin cambio alguno en las posiciones de los átomos.
Las estructuras resonantes son útiles porque permiten representar moléculas, iones o radicales para los cuales resulta inadecuada una sola estructura de Lewis. Dichas estructuras se conectan con flecha de doble punta y se dice que la molécula, radical o ion real es la suma de todas ellas (híbrido).
Es importante que al escribir estructuras de resonancia deben seguirse las siguientes reglas generales:
1. Observar que la estructura posea electrones alternados a lo largo de su esqueleto. Tener electrones alternados es indicativo de que se puede representar a la misma molécula con diferente arreglo de electrones.
2. Trazar estructuras resonantes sólo involucra el movimiento de electrones. Las posiciones de los átomos deben permanecer iguales en todas las estructuras.
3. Definir el tipo de flechas curvas a emplear. Si son iones se emplean flechas curvas de punta completa, si son radicales involucra el empleo de flechas curvas de mediapunta.
4. Todas las estructuras deben ser propiamente estructuras de Lewis. Nunca se deben escribir estructuras en las cuales el átomo de carbono tenga cinco (5) enlaces.
5. Cada estructura de resonancia se separa por una flecha de doble punta y habitualmente se representan entre corchetes.
6. Tome en cuenta que ninguna de las estructuras trazadas, representa la estructura real de la molécula o ion. La estructura real se representa como un híbrido (la suma de todas las estructuras creadas), al cual se le conoce como híbrido de resonancia
7. Mientras más estable sea una estructura, más contribuye al híbrido de resonancia.
8. Las estructuras de resonancia en las que todos los átomos tengan completo su octeto de electrones, son las más estables, aunque ello suponga la presencia de una carga positiva en un átomo electronegativo.
9. Las estructuras iónicas con separación de cargas son más inestables que las que no poseen cargas.
10. Entre dos estructuras con separación de cargas, será más importante la estructura con la carga negativa en el átomo más electronegativo.
11. Cuanto mayor sea el número de estructuras de resonancia que puedan escribirse para una molécula, se dice que gana energía de resonancia y por lo tanto esta molécula será más estable
Tomando en cuenta las reglas mencionadas escriba estructuras de resonancia para las siguientes especies:





No hay comentarios.:
Publicar un comentario